近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室科研团队首次在原核生物构建了人工无膜细胞区室,揭示了类蛛丝蛋白、节肢弹性蛋白等固有无序蛋白液-液相分离区室化的生物大分子机制,建立了荧光蛋白、酶等蛋白融合共定位至区室的功能化平台。相关研究成果以“Formation and functionalization of membraneless compartments in Escherichia coli”为题发表于Nature Chemical Biology杂志。上海交通大学研究生韦绍鹏、胡春飞及合作研究的钱志刚副研究员为共同第一作者,夏小霞教授为通讯作者,该文作者还包括受聘上海交通大学顾问教授的韩国科学技术院李相烨教授等。
生命体进化经历了从无到有、从简单到复杂的过程。在复杂的真核细胞内,存在经典的有膜细胞器和没有脂膜包被的无膜细胞器。这类近年才备受关注的无膜细胞器,广泛分布于细胞核、细胞质甚至细胞膜上,形成类似于胞内“小液滴”的特殊微环境,通过富集蛋白质、核酸等大分子参与代谢等重要的生理和病理过程。在尚未进化出有膜细胞器的原核细胞中,是否存在无膜的亚细胞结构,启发生物学家的深入思考和长期探索。
该团队长期研究蛋白质材料的设计及微生物合成,仿生合成的蛛丝蛋白、类节肢弹性蛋白,因为含有高度重复的固有无序结构域,与真核生物中的无膜细胞器蛋白组分极为类似。受此启发,该团队首先考察上述材料蛋白在原核细胞中的定位,发现经荧光标记的目标蛋白在模式细胞大肠杆菌的两极形成聚集体(见图1),与基本不可溶、无活性的包涵体迥然不同,而且未进行标记的材料蛋白本身也拥有类似的区室化行为。该团队通过体外重构模拟胞内微环境,揭示了材料蛋白液-液相分离形成亚细胞区室的分子机制。在此基础上,研究中将金属硫蛋白等具有催化功能的酶分子与材料蛋白融合,通过单个或多个融合蛋白的胞内区室化共定位,实现了预期的人工无膜区室功能化,展现了原核细胞内生物合成时空可控的可行性和优越性。
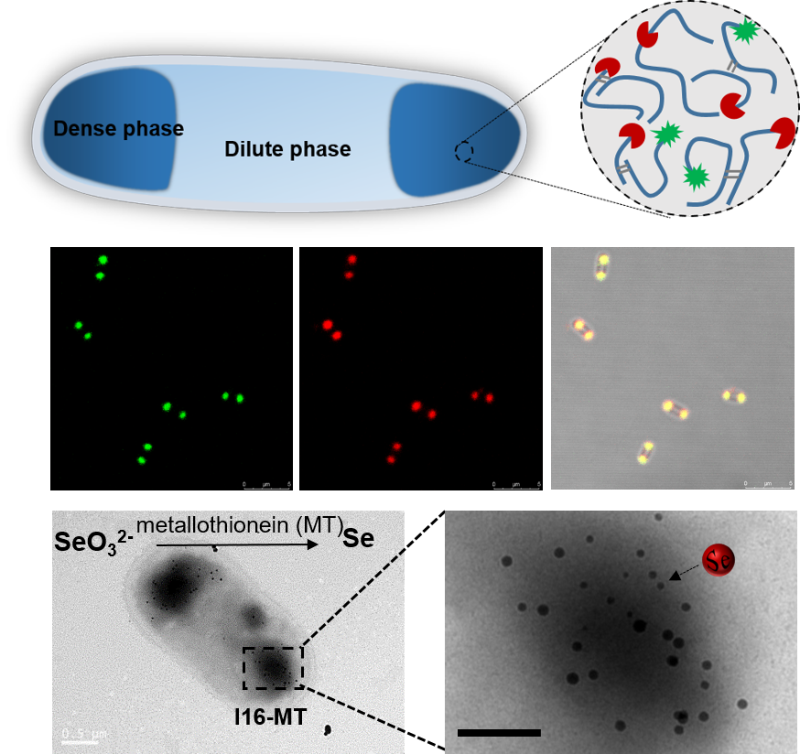

图1 人工无膜细胞器的形成及功能化
该研究受真核无膜细胞器启发,赋予了原核生物原本不具备的功能化无膜区室,不仅打破了这类细胞器仅限于真核细胞的固有认知局限,而且破解了由于胞内固有环境的差异难以将已有真核无膜细胞器嫁接到原核细胞的天然障碍,为原核细胞内生化反应的人工时空调控及其合成生物学应用提供了新机遇。
该研究获得国家自然科学基金(21674061,21406138和31470216)和科技部国家重点研发计划(2016YFE0204400)的资助。





































